فلزات، بیشترین سهم از خانههای جدول تناوبی عناصر، به ویژه سمت چپ جدول را، به خود اختصاص دادهاند. این طیف گسترده از عناصر فلزی در جایگاههای مختلفِ این جدول، حکایت از نقشآفرینی آنها در جایگاههای متنوعِ صنایع و درنتیجه پیوندِ زندگی انسانها با این عناصرِ الکترونده دارد. فلزات را بر اساس قواعد مشخصی که همسو و هماهنگ با یک سری از ویژگیهای آنها است، در گروههای تفکیکی هدفمندی در جدول قرار میدهیم که هدف مقاله حاضر، علاوه بر آشنایی اجمالی با این عناصر، پرداخت به این دستهبندیها و نگاهی کلی به ویژگیهای قانونمندِ هر دسته است.
فلزات در جدول تناوبی عناصر
همانگونه که در مقدمه عنوان کردیم، فلزات دربرگیرنده بالاترین تعداد خانههای جدول تناوبی هستند.
به سبب حضور گسترده فلزات در ابعاد مختلف زندگی روزمره، به طور تجربی و شهودی برخی از آنها را میتوانیم به سادگی تشخیص بدهیم. اکنون میخواهیم ببینیم از منظر علمی، چه عناصری را به عنوان عناصر فلزی یا فلزات تعریف میکنیم.
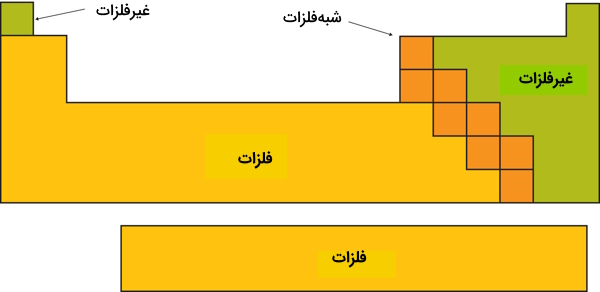
تعریف فلزات یا عناصر فلزی
در حالت کلی فلزات را به صورت عناصری با گرایش به الکتروندهی و تشکیل یونهای با بار مثبت، کاتیونها، تعریف میکنیم.
حال میخواهیم بدانیم که یک عنصر باید چه شرایط یا ویژگیهایی داشته باشد تا بتواند به راحتی الکترون خود را از دست داده و جزو فلزات تلقی شود.
ویژگیهای لازم برای فلز بودن عناصر
چند ویژگی لازم برای از دست دادن سادهتر الکترونها در عناصر که دلالت بر فلز بودن آنهاست، از این قرار است:
اگر عناصری دارای ویژگیهای یادشده باشند، در این صورت مانند فلزات رفتار خواهند کرد.
تعداد فلزات در جدول تناوبی عناصر
سوالی که در مورد تعداد کل فلزات جدول تناوبی مطرح میشود، این است که در جدول تناوبی چند عنصر فلزی وجود دارد؟ باید بگوییم که پاسخ دقیقی برای این سوال وجود ندارد، چون مرزهای بین فلزات، نافلزها و شبهفلزات، به دلیل عدم وجود تعاریف پذیرفتهشده جهانی، کمی در نوسان است، به عنوان مثال، در علم متالورژی، ممکن است محققان فلزات را بر اساس چگالی آنها تعریف کنند، در فیزیک، بر اساس ویژگیهای فیزیکی و در شیمی، دانشمندان حوزه به ویژگیها شیمیایی آنها توجه بیشتری داشته باشند.
علاوه بر موارد فوق، برخی از عناصر (عناصر ۱۰۹ تا ۱۱)، همچنان در دست تحقیق توسط محققان است. آنها عناصری مصنوعی (Synthetic) بوده و دارای نیمهعمر (Half Life) بسیار کوتاهی هستند، از اینرو تعداد کل فلزات هنوز به طور دقیق مشخص نیست.
اگر ۱۰۸ عنصر اول را در نظر بگیریم، میتوانیم بگوییم در مجموع ۸۴ فلز در جدول تناوبی وجود دارد.اما در حالت دقیقتر میتوان گفت از مجموع ۱۱۸ عنصر شناخته شده، بیش از ۷۸ درصد آنها دارای ویژگیهای فلزی هستند.
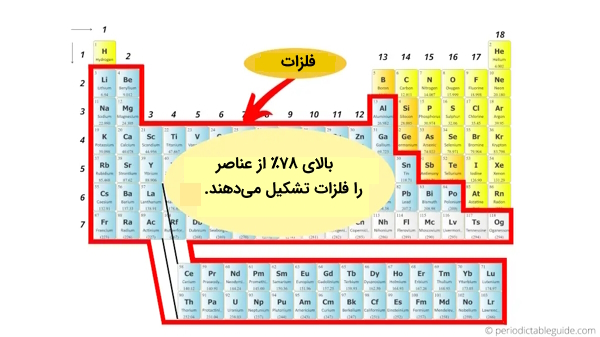
موقعیت فلزات در جدول تناوبی
با توجه به تصاویر و موقعیتهای عناصر، متوجه میشویم که فلزات، بیشتر در سمت چپ جدول تناوبی قرار دارند. در این قسمت میخواهیم دلایل علمی آن را مورد بررسی قرار بدهیم و ببینیم چرا بیشتر عناصرِ سمت چپ جدول تناوبی را فلزات تشکیل میدهند. گفتیم برای اینکه عنصری فلز باشد، لازم است بتواند الکترون یا الکترونهای خود را به سادگی از دست بدهد و برای این امر نیز لازم است دارای یک سری ویژگیها باشد که در اینجا به بررسی یکیک این ویژگیها در عناصر سمت چپِ جدول میپردازیم.
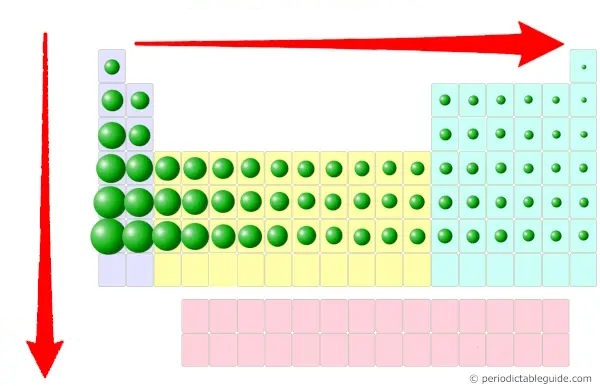
- انرژی یونیزاسیون (یونش) پایین: یکی از ویژگیهای عناصر فلزی، پایین بودن انرژی یونیزاسیون است که برای بررسی این مورد در عناصر، لازم است نگاهی به شعاع یا سایز اتمی داشته باشیم. میدانیم که در جدول تناوبی، سایز اتمی در یک گروه، از بالا به پایین افزایش و در یک دوره، از چپ به راست کاهش مییابد، به بیان دیگر، در گروه از بالا به پایین و در دوره از راست به چپ افزایش مییابد. پس از آنجایی که این عناصر، عناصر سمت چپ جدول، دارای اندازه اتمی بزرگتری هستند، شرایط آنها برای از دست دادن الکترونها مطلوبتر بوده و حذف الکترونهای ظرفیت (الکترونهای بیرونیترین لایه آنها) آسانتر است که این به معنی پایینتر بودن انرژی یونیزاسیون آنهاست.
- الکترونهای ظرفیت پایینتر: میدانیم عناصر سمت چپ جدول تناوبی دارای الکترونهای کمتری در بیرونیترین لایه خود، یعنی لایه ظرفیت هستند که یکی از ویژگیهای عناصر فلزی است.
- الکترونگاتیوی پایینتر: از دیگر ویژگیهای عناصر فلزی، پایینتر بودن الکترونگاتیوی آنها است که برای بررسی این مورد در عناصر جدول تناوبی، یادآوری مختصری از مفهوم آن میکنیم. الکترونگاتیوی تمایل به جذب جفتالکترون است و میدانیم که الکترونگاتیوی یک اتم به اندازه آن بستگی دارد. اگر اندازه اتمی کمتر باشد، تمایل بیشتری برای جذب جفتالکترون دارد (اندازه کوچکتر، الکترونگاتیوی بیشتر) و اگر اندازه اتمی بیشتر باشد، تمایل کمتری به جذب جفتالکترون خواهدداشت و الکترونگاتیوی کمتر است. حال با توجه به بالاتر بودن شعاع اتمی و اندازه عناصر سمت چپ جدول تناوبی، دارای الکترونگاتیوی کمتر و ماهیت فلزی بیشتری خواهند بود.
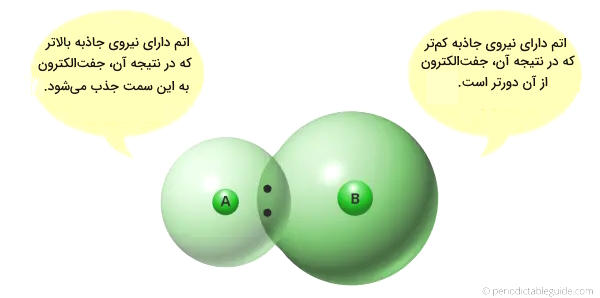
به طور خلاصه به یاد داشته باشیم که:
- فلزات اهداکننده یا دهنده الکترون هستند.
- عناصری که این نوع ماهیت را از خود نشان میدهند، ماهیت الکتروندهی، به عنوان عناصر فلزی شناخته میشوند.
- در جدول تناوبی، فلزات، بیشتردر سمت چپ جدول یافت میشوند.
ویژگیهای فیزیکی فلزات
در راستای ویژگیهای بارز فلزات، به برخی از آنها به شرح زیر میتوانیم اشاره داشته باشیم. لازم است این نکته را مد نظر قرار دهیم که بیشتر ویژگیهای عنوانشده برای فلزات، در مورد اکثریت، و نه الزاما تمامی آنها، برقرار است.
برخی از ویژگیهای مذکور عبارتند از:
- جامد بودن در دمای اتاق: فلزات در دمای اتاق جامد، دارای شکل و اندازه مشخص، هستند، به استثنای جیوه (Mercury) به عنوان تنها فلز مایع.
- «براق بودن» (Lustrous or Shiny): فلزات، براق و اصطلاحا دارای درخشندگی فلزی هستند.
- «چکشخواری» (Malleability): در صورت وارد آوردن فشار کافی بر فلزات، میتوان آنها را تبدیل به ورقههایی نازکتر کرد که این ویژگی به عنوان چکشخواری تعریف میشود.
- «شکلپذیری» (Ductility): با اعمال کشش کافی به فلزات، میتوان آنها را به فرم سیمهای نازک تبدیل کرد، به عنوان مثال میتوانیم به سیمهای کابل (Cable Wires)، سیمهای مسی نازک مورد استفاده در مدارهای الکتریکی (Electric Circuit) در لپتاپ، تلفن و… اشاره کنیم.
- نقطه ذوب و نقطه جوش بالا: بیشتر فلزات – و نه همه آنها – نقطه ذوب و همچنین نقطه جوش بالایی دارند.
- «رسانایی» (Conductivity) الکتریکی و حرارتی: بیشتر فلزات رساناهای الکتریکی و حرارتی خوبی هستند، به این معنی که الکتریسیته و گرما به راحتی میتواند از آنها عبور کند.
- «چگالی» (Density): اکثر فلزات چگالی یا دانسیته و درنتیجه وزن بالایی دارند که البته لیتیوم، پتاسیم و سدیم از استثناها در این زمینه است.
- «سختی» (Hardness): سختی ماده را به صورت توانایی مقاومت آن در برابر در برابر سایش، پارگی، خراش و مقاومت در برابر تغییر شکل تعریف میکنیم. به طور کلی، اکثر فلزات، به جز جیوه که جامد نیست، این ویژگیها را از خود نشان میدهند، البته لازم است توجه کنیم که فلزات سدیم، پتاسیم و لیتیوم نیز فلزاتی نرم هستند که قابلیت برش با چاقوی آشپزخانه را دارند.
ویژگیهای شیمیایی فلزات
به برخی از ویژگیهای شیمیایی مشترک در فلزات، به شرح زیر میتوانیم اشاره داشته باشیم.
- «ظرفیت» (Valency): در حالت کلی، اتمهای فلزی دارای ۱، ۲ یا ۳ الکترون در بیرونیترین لایه خود هستند که این الکترونها را در طی واکنشهای شیمیایی از دست میدهند.
- «خورندگی» (Corrosiveness): بیشتر فلزات مانند آهن، هنگامیکه در معرض آب یا هوای مرطوب قرار میگیرند، به سادگی خورده می شوند.
- «الکتروندهی» (Loss of Electrons): همانطور که در تعریف فلزات اشاره شد، این عناصر تمایل به از دستدادن الکترون دارند و در طی واکنشهای شیمیایی الکترون یا الکترونهای خود را اهدا کرده و تشکیل کاتیون میدهند.
- «الکترونگاتیوی پایین» (Low Electronegative): فلزات دارای الکترونگاتیوی پایین بوده و از این رو دارای ماهیت «الکتروپوزیتیو» (Electropositive) هستند.
- واکنشپذیری (Reactivity): برخی فلزات از نظر شیمیایی واکنشپذیرترند، به این صورت که توسط خود یا عناصر دیگر تحت واکنشهای شیمیایی قرار گرفته و انرژی آزاد میکنند، به عنوان مثال: زمانی که پتاسیم را در معرض آب قرار بدهیم، به طور خودکار و خطرناکی مشتعل میشود.
- عوامل کاهنده خوب (Good Reducing Agents): فلزات عوامل کاهنده خوبی هستند، چون در طی واکنشهای شیمیایی الکترون یا الکترونهای خود را از دست داده و اکسید میشوند.
- انرژی یونیزاسیون پایینی: متوجه شدیم که انرژی یونیزاسیون پایین، یکی از مشخصههای عناصر فلزی است.
طبقهبندی فلزات جدول تناوبی عناصر
تا اینجای کار یاد گرفتیم چه عناصری با چه ویژگیهایی فلز هستند و چه درصدی از کل عناصر را تشکیل میدهند و دارای چه کاربردهایی هستند. حال میخواهیم به دستهبندی آنها بپردازیم. قبل از هرچیز لازم است به این نکته اشاره کنیم که طبقهبندی عناصر بعضا مشمول دیدگاههای مختلف بوده و از این رو الزاما دارای مرزبندی دقیقی نیستند.
عناصر فلزی در جدول تناوبی را، در جایگاههایی که به تناسب ویژگیهای خود قرار دارند، به دستههای اصلی و فرعی زیر تقسیمبندی میکنیم.
در ادامه به بررسی اجمالی هر دسته از این فلزات اشاره میکنیم و برای مطالعه جامعتر در مورد هریک، میتوانیم به مقالههای اختصاصی آنها مراجعه داشته باشیم.
فلزات قلیایی
فلزات قلیایی چیست و چرا به این نام خوانده می شوند؟ پاسخ ساده این است که بگوییم فلزات قلیایی هنگام واکنش با آب، تشکیل محلول قلیایی (بازی) داده و به همین دلیل به نام فلزات قلیایی شناخته میشوند.
موقعیت در جدول تناوبی
عناصر ستون اول، گروه ۱ یا گروه IA جدول تناوبی، فلزات قلیایی هستند. این فلزات که در مقالهای جدا به طور مبسوط مورد بررسی قرار گرفتهاند، عناصری هستند که ویژگی اصلی مشترک در آنها، وجود یک الکترون در لایه الکترونی بیرونی است. این الکترونتنها، پیوند سستی داشته که موجب میشود این عناصر، به مجموعهای از عناصر واکنشپذیر تبدیل شوند.
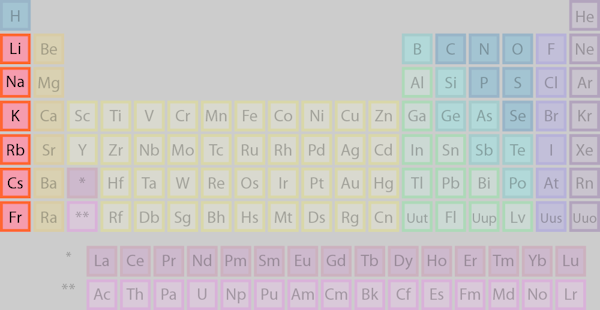
توجه: هیدروژن عنصری است که به طور ثابت در دسته فلزات قلیایی قرار ندارد. زمانیکه هیدروژن تحت شرایط ویژه، در حالت فلزی خود یافت میشود، یک فلز قلیایی خواهد بود، ولی در دماها و فشارهای معمولی، به صورت گاز بوده و ویژگیهای نافلزات را دارد.
ویژگیهای فلزات قلیایی
الکترونتنها در لایه بیرونی یا لایه ظرفیت عناصر فلزات قلیایی، آنها را به سمت ویژگیهایی مشترک هدایت می کند که عبارتند از:
- از دست دادن راحتتر الکترون بیرونی و تشکیل کاتیون تکظرفیتی ($$۱^{+}$$)، به عنوان مثال $$Na^{+}$$.
- چگالی کمتر نسبت به سایر فلزات
- دارای بیشترین شعاع اتمی در دورهها
- بسیار واکنشپذیر هستند، به ویژه به سادگی با هالوژنها و سایر نافلزات واکنش نشان میدهند. فلزات خالص با اکسیژنِ هوا و آب وارد واکنش میشوند. نیز میدانیم با حرکت از بالا به پایین در گروهها، واکنشپذیری افزایش مییابد، به عنوان مثالی از این مورد میتوانیم بگوییم که قطعهای از فلز سدیم ( Na) در آب میسوزد، در حالیکه قطعهای از فلز سزیم (Cs)، در آب منفجر میشود، یعنی واکنشپذیری بالاتری دارد.
- انرژی یونیزاسیون پایینتر
- الکترونگاتیوی پایینتر
- برخلاف اکثر فلزات، فلزات قلیایی تمایل بالاتری به نرمشدن از خود نشان داده و نقطه ذوب پایینتری دارند، به عنوان مثال، فلز سدیم قابلت برش دارد، نیز نقطه ذوب فلز سزیم به حدی پایین است که از طریق حرارتِ دست یا حرارت اتاقی گرم، ذوب میشود.
- از نظر ظاهری، مانند سایر فلزات، براق بوده و نیز رسانای الکتریکی و رسانای حرارتی خوبی هستند.
فلزات قلیایی خاکی
چرا عناصر گروه دوم را به عنوان فلزات قلیایی خاکی میشناسیم؟ عناصر گروه ۲ دارای ویژگیهای تقریبا مشابهی با عناصر گروه ۱ (فلزات قلیایی) هستند، اما تفاوت در این است که آنها بیشتر از پوسته زمین یافت شده و به همین دلیل به عنوان فلزات قلیایی خاکی شناخته می شوند.
موقعیت در جدول تناوبی
فلزات قلیایی خاکی، ۶ عنصر ستون یا همان گروه دوم از جدول تناوبی را شامل می شوند که در تصویر مشاهده میکنیم.

ویژگیهای فلزات قلیایی خاکی
اتمهای هر یک از عناصر قلیایی خاکی، دارای دو الکترون در لایه ظرفیت خود هستند که این امر باعث ایجاد ویژگیهایی مشترک در آنها شده است که برخی از آنها عبارتند از:
- دارای یک پوسته الکترونی S بیرونی کامل هستند، با ۲ الکترون، به این معنی که این عناصر، کاتیونهایی با بار دو تشکیل داده و دارای حالت اکسیداسیون $$۲^{+}$$ هستند.
- میل ترکیبی الکترونی کم و درنتیجه الکترونگاتیوی پایینتری دارند.
- در دما و فشار معمولی فلزاتی براق و نقرهایرنگ هستند.
- فلزاتی چکشخوار و انعطافپذیر هستند
- نرم و دارای چگالی، نقطه ذوب و نقطه جوش نسبتا پایینی هستند، با این حال نقطه ذوب و جوش آنها، بسیار بالاتر از غیرفلزات است. همچنین این عناصر در حالیکه نرم هستند، سختتر از عناصر گروه اول، فلزات قلیایی، هستند.
- نسبتا واکنشپذیر بوده و با حرکت به سمت پایین، واکنشپذیری آنها افزایش مییابد، مثلا فلز استرانسیوم (Sr)، واکنشپذیرتر از کلسیم است و به همین ترتیب برای سایر عناصر.
- فلزات قلیایی خاکی در طبیعت آزاد نبوده و در ترکیبات یافت میشوند.
- به آسانی با هالوژنها (Cl، Br و … ) واکنش داده و تشکیل هالید میدهند. همچنین با اکسیژن واکنش و تشکیل اکسید میدهند.
فلزات واسطه
فلزات واسطه یا عناصر انتقالی، بزرگترین گروه از عناصر جدول تناوبی را تشکیل میدهند. در سال ۱۹۲۱، چارلز بوری، شیمیدان انگلیسی، یک سری انتقالی (Transition Series) از عناصر را توضیح داد. بوری انتقال از یک لایه الکترونی داخلی با ۸ الکترون به لایه الکترونی با ۱۸ الکترون و از لایه ۱۸ الکترونی به لایه ۳۲ الکترونی را مورد بررسی قرار داد.
در واقع این فلزات به مثابه پلی بین فلزات فعالِ شیمیایی (Chemically Active Metals) عناصر بلوک S و عناصر کمتر فعالِ گروههای ۱۳ و ۱۴ عمل میکنند و از این رو آنها را به عنوان فلزات انتقالی شناخته میشناسیم.
با حرکت از چپ به راست در جدول تناوبی، یک الکترون به اوربیتال d هر اتم اضافه و از گروه ۲ به گروه ۱۳ منتقل میشوند.
موقعیت در جدول تناوبی
عناصر موجود در گروههای ۳ تا ۱۲ جدول تناوبی را به عنوان فلزات واسطه میشناسیم.
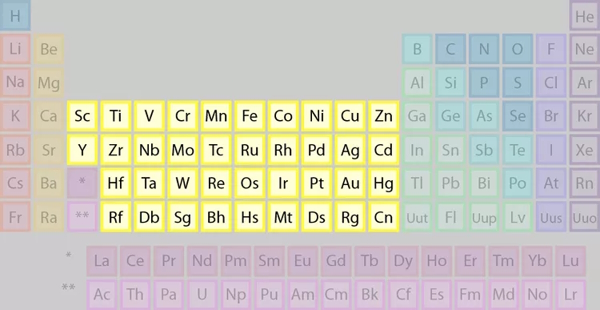
تعریف IUPAC برای فلزات واسطه
رایجترین تعریف برای فلزات واسطه، تعریفی است که توسط آیوپاک (IUPAC) پذیرفته شده است. بر اساس این تعریف، فلز واسطه، عنصری با زیرلایه d نیمهپر یا قابلیتِ تولید کاتیون با زیرلایه d نیمهپر است.
افراد دیگری و در تعاریف دیگری، فلزات واسطه را شامل هر عنصری از بلوک d جدول قلمداد میکنند، یعنی طبق این تعریف، گروههای ۳ تا ۱۲ فلزات واسطه بوده و سریهای لانتانید و اکتینید در بلوک f را «فلزات واسطه داخلی» مینامیم که در ادامه بیشتر مورد بررسی قرار میدهیم.
با استفاده از تعریف IUPAC، چهل فلز واسطه خواهیم داشت که عبارتند از:
- عناصر دارای اعداد اتمی ۲۱ (اسکاندیم) تا ۳۰ (روی)
- عناصر دارای اعداد اتمی ۳۹ (ایتریوم) تا ۴۸ (کادمیم)
- عناصر دارای اعداد اتمی ۷۱ (لوتسیم) تا ۸۰ (جیوه)
- عناصر دارای اعداد اتمی ۱۰۳ (لارنسیم) تا ۱۱۲ (کوپرنیسیم)
چند نکته پیرامون فلزات واسطه:
- از نظر تکنیکی، عناصر روی، کادمیوم و جیوه، در گروه ۱۲، باید به عنوان فلزات پساواسطه یا فلزات پسواسطه (Post-Transition Metals) در نظر گرفته شوند، زیرا آنها دارای آرایش الکترونی کامل $$d_{۱۰}$$ بوده و به طور معمول یونهایی تولید میکنند که این آرایش را در آنها حفظ میکند.
- در سال ۲۰۰۷، شواهدی تجربی از رفتار جیوه به عنوان یک فلز واسطه به دست آمد. احتمالا عنصر کوپرنیسیم (Cn) (Copernicium) را باید بر همین اساس کنار بگذاریم، اگرچه ویژگیهای اکسیداسیون آن به طور تجربی تایید نشده است، با این حال، اکثر افراد این عناصر را در لیست فلزات انتقالی قرار میدهند که در جدول بالا نیز در این گروه نمایش داده میشود.
- برخی افراد عنصر لوتنیم یا لوتسیم (Lu) (lutetium) و لارنسیم (Lr) (lawrencium) را از این لیست حذف میکنند، اما این دو عنصر، از نظر فنی و تکنیکی جزو عناصر گروه ۳ هستند که در قسمت جدایی از جدول تناوبی قرار میگیرند. نیز هستند دانشمندانی که سری کامل لانتانیدها و اکتینیدها را نیز به عنوان فلزات واسطه به حساب میآورند.
ویژگیهای فلزات واسطه
فلزات واسطه چندین ویژگی مشخص دارند:
- توانایی تشکیل محلولهای آبی رنگی را دارند.
- اتمهای آنها دارای ویژگی فلزی هستند و به راحتی الکترون خود را از دست میدهند.
- اغلب تشکیل ترکیبات رنگی را میدهند که رنگها به دلیل انتقالهای الکترونی d-d است.
- به سادگی تشکیل کمپلکس (Complex) میدهند.
- حالتهای اکسیداسیون مثبت متعددی بروز میدهند که به دلیل شکاف انرژی کم بین حالات است.
- کاتالیزورهای خوبی هستند.
- پارامغناطیس (Paramagnetic) بوده و جذب میدان مغناطیسی میشوند. به طور کلی، پارامغناطیسها از الکترونهای d جفتنشده ناشی میشود. سه عنصر مهم در این زمینه عبارتند از: آهن، کبالت و نیکل که هر سه عنصر، میدان مغناطیسی ایجاد میکنند.
- به استثنای مس و طلا، در دمای اتاق فلزاتی نقرهای رنگ هستند.
- به استثنای جیوه، در دمای اتاق جامد هستند.
- درخشندگی فلزی دارند.
- انرژی یونیزاسیون پایینی دارند.
- سخت هستند.
- به استثنای جیوه، دارای نقطه ذوب و جوش بالایی هستند.
- رسانای الکتریکی و حرارتی خوبی هستند.
- تشکیل آلیاژ میدهند.
فلزات واسطه داخلی
همانطور که از نام آنها بر میآید، در بخش داخلی فلزات واسطه قرار دارند، در واقع ارتباط نزدیکی با فلزات واسطه داشته و از این رو آنها را با این نام، فلزات واسطه داخلی یا عناصر انتقالی داخلی، میشناسیم. دو ردیف پایین در جدول تناوبی، فلزات واسطه داخلی نامیده می شوند. عناصر ردیف اول به نام لانتانیدها و عناصر ردیف دوم به نام اکتینیدها شناخته میشوند.
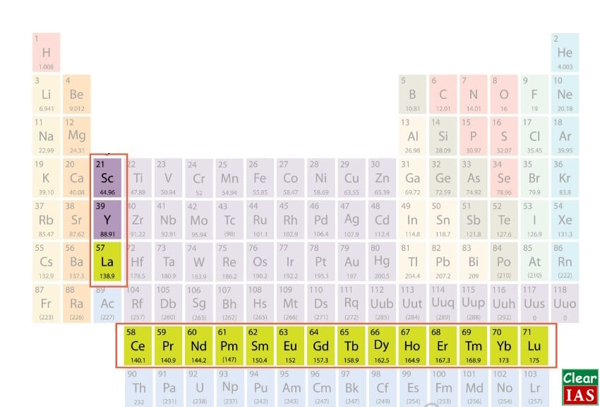
لانتانیدها
لانتانیدها شامل عناصر ۵۷ تا ۷۱ جدول (La تا Lu) هستند. شیمیدانان از نماد Ln برای اشاره به این ۱۵ عنصر استفاده میکنند. علت نامگذاری آنها با این نام، این است که دارای ویژگیهای مشترکی با عنصر لانتانیم یا لانتان (La) (Lanthanum) هستند. این عناصر، با نام سری لانتانید نیز شناخته میشوند.
موقعیت در جدول تناوبی
همانطور که در تصویر مشخص است، لانتانیدها در ردیف بالایی از دو ردیف از عناصر موجود در زیر قسمت اصلی جدول تناوبی، قرار دارند. قرار دادن لانتانیدها و اکتینیدها (عناصر ردیف زیر لانتانیدها) در زیر عناصر دیگر فقط جنبه زیبایی و ظاهری دارد.
یادآوری: علامت ستاره (*) در تصویر پایین و در کنار ردیف لانتانیده و نیز بالای جدول، نشاندهنده جایگاه این عناصر در قسمت اصلی جدول، خانه ستارهدار، است که به دلیل زیبایی و نظم بیشتر، در ردیف مجزا نمایش داده میشود.































































ویژگیهای لانتانیدها
لانتانیدها چندین ویژگی مشترک دارند که به برخی از آنها اشاره میکنیم:
- با توجه به اینکه لانتانیدها عناصر بلوک f یا فلزات واسطه داخلی هستند، اتمهای این عناصر دارای الکترونهای بیشتری در اوربیتال f داخلی است، البته برخی از منابع لانتانیم را یک عنصر بلوک d میدانند، درحالیکه برخی دیگر آنرا به عنوان یک عنصر بلوک f به حساب میآورند، زیرا شروعکننده این سری است، حتی اگر اوربیتال f آن خالی باشد.
- فلزات جامدِ واکنشپذیرِ نقرهایرنگ هستند که در هوا کدر میشوند.
- فلزاتی به نسبت نرم بوده و سختی آنها با عدد اتمی، افزایش مییابد.
- نقطه ذوب و جوش بالایی دارند.
- حالتهای اکسیداسیون متعددی از خود نشان میدهند. حالت $$۳^{+}$$ پایدارترین حالت است، اما حالات اکسیداسیون $$۲^{+}$$ و $$۴^{+}$$ نیز رایج است.
- این عناصر با آب واکنش داده و گاز هیدروژن آزاد میکنند. واکنش در دماهای بالاتر با سرعت بیشتری انجام میگیرد.
- واکنش لانتانیدها با $$H^{+}$$ (اسید رقیق) برای آزادسازی $$H_{۲}$$ انجام میشود. این واکنش در دمای اتاق به سرعت انجام میشود.
- این عناصر با گاز هیدروژن به صورت گرمازا واکنش میدهند.
- لانتانیدها عواملی با قدرت احیاکنندگی بالا هستند.
- بسیاری از لانتانیدها در هوا میسوزند.
- بسیاری از ترکیبات لانتانیدی، یونی و پارامغناطیس هستند.
- بسیاری از ترکیبات لانتانیدی، زیر نور فرابنفش حالت فلورسانس دارند.
- مانند فلزات واسطه، لانتانیدها نیز کمپلکسهای رنگی تشکیل میدهند. با این حال، رنگها به دلایل اپتیکی، به رنگ کمرنگتر یا پاستلی متمایلند.
- لانتانیدها دارای اعداد همسایگی بالایی هستند، بزرگتر از ۶، معمولا ۸ یا ۹، اما ممکن است به ۱۲ هم برسد. میدانیم اعداد همسایگی در طول دورهها کاهش مییابد.
پدیده «انقباض لانتانید» (Lanthanide Contraction):
با حرکت از چپ به راست در جدول، با افزایش عدد اتمی، شعاع یونهای لانتانید $$۳^{+}$$ به جای افزایش، کاهش مییابد که از این پدیده با عنوان «انقباض لانتانید» یاد میشود.
اکتنیدها
اکتینیدها شامل عناصری با اعداد اتمی ۸۹ تا ۱۰۳، گروهی متشکل از ۱۵ عنصر البته با برخی اختلافنظرها در این خصوص، است. این گروه همچنین به عنوان سری اکتینید نیز شناخته میشود. به جز لارنسیم (Lr) (Lawrencium) که یک عنصر بلوک d است، سایر عناصر این سری، جزو عناصر بلوک f هستند، یعنی آرایش الکترونی شامل لایه فرعی f است. معمولا اکتینیدها از عنصراکتینیم (Ac) (Actinium) تا لارنسیم را در بر میگیرند، اگرچه برخی شیمیدانان بر این باورند که این سری با عنصر توریم (Th) (Thorium) شروع میشود.
تمامی این عناصر، فلزاتی رادیواکتیو بوده و از این رو در شیمی هستهای (Nuclear Chemistry) از اهمیت بالایی برخوردارند.
موقعیت در جدول تناوبی
در جدول تناوبی، اکتینیدها در ردیف پایین جدول، پایین ردیف لانتانیدها، قرار دارند.
یادآوری: علامت دوستاره (**) نشانداده شده در جدول، مبین آن است که جایگاه این عناصر بین عنصر رادیوم (Ra) با عدد اتمی ۸۸ و رادرفوردیوم (Rf) (Rutherfordium) با عدد اتمی ۱۰۴ قرار است.

































































































































ویژگیهای اکتنیدها
از ویژگیهای اکتنیدها میتوان به موارد زیر اشاره داشت:
- تمامی آنها، عناصری رادیواکتیو بوده و ایزوتوپ (Isotope) پایداری ندارند.
- به طور متوالی زیرلایه ۵f را پر میکنند.
- بسیاری از این عناصر دارای ویژگیهای مشترکی با عناصر بلوک d و بلوک f هستند.
- فلزاتی نقرهایرنگ بوده و در دما و فشار اتاق، جامد هستند.
- بسیار الکتروپوزیتیو بوده و نیز دارای چندین حالت اکسیداسیون هستند.
- به راحتی با اکثر نافلزات تشکیل ترکیب میدهند.
- به راحتی در هوا کدر میشوند.
- تمامی اکتینیدها فلزاتی نسبتا نرم بوده و حتی ممکن است برخی از آنها با چاقو بریده شوند.
- چکشخوار و انعطافپذیر هستند.
- فلزاتی سنگین یا متراکم هستند.
- تمامی اکتینیدها پیروفوریک (Pyrophoric) هستند و وقتی به حالت پودر ریز در آورده شوند، خودبهخود در هوا مشتعل میشوند.
- تمامی آنها پارامغناطیس (Paramagnetic) هستند.
- دارای فازهای کریستالی یا آلوتروپهای متعددی هستند، به عنوان مثال پلوتونیوم (Pu) (Plutonium) دارای حداقل شش آلوتروپ است.
- با اسید رقیق یا آب جوش واکنش داده و تولید گاز هیدروژن میکنند.
- به آسانی تحت واکنشهای هستهای (Nuclear Reactions) قرار میگیرند، این واکنشها مقادیر بالایی انرژی آزاد میکنند. تحت شرایطی خاص، ممکن است واکنشهای زنجیرهای (Chain Reactions) نیز به وقوع بپیوندد.
فلزات کمیاب خاکی
فلزات کمیاب خاکی شامل تمامی ۱۵ عنصر از لانتانیدها، اسکاندیم (Sc) (Scandium) و ایتریم (Y) (Ytrium) است. در مجموع ۱۷ فلز کمیاب خاکی در جدول تناوبی وجود داریم.
۱۵ عنصر از لانتانیدها + اسکاندیم + ایتریم = ۱۷ عنصر کمیاب خاکی
ممکن است این سوال پیش بیاید که چرا فلزات کمیاب خاکی به این نام خوانده می شوند؟ این فلزات، آنقدرها که از نام آنها بر میآید کمیاب نبوده و حتی در مقادیری فراوانتر از عنصر طلا در دسترس هستند، اما واقعیت این است که آنها به طور تقریبا یکنواخت روی زمین پخش شده و یافتن منایع این عناصر در یک نقطه متمرکز از زمین بسیار دشوار است، از این رو نادر بودن آنها به دلیل نادر بودن منابع موجود آنها است.








فلزات سنگین
فلزات سنگین، فلزات دارای چگالی یا جرم اتمی بالاتری هستند. لازم است به این نکته توجه داشته باشیم که تعریف فلزات سنگین نیز ممکن است در علوم متالورژی، فیزیک و شیمی متفاوت باشد. به این صورت که در متالورژی، محققان فلزات سنگین را بر اساس چگالی آنها تعریف میکنند، در فیزیک، ممکن است از اعداد اتمی برای تعریف فلزات سنگین استفاده کنند و در شیمی، شیمیدانان به ویژگیها شیمیایی فلزات سنگین برای تعریف آنها توجه دارند، بنابراین تحقیقات برای تعریف و طبقهبندی دقیقتر فلزات سنگین ادامه دارد.
بسیاری از محققان از معیارهای رایج استفاده میکنند، به این حالت که اگر چگالی فلزی بیش از ۵ گرم بر سانتیمتر مکعب باشد، احتمالا به عنوان فلز سنگین شناخته میشوند که بر اساس همین معیار نیز، این فلزات را در جدول تناوبی به تصویر کشیدهایم.
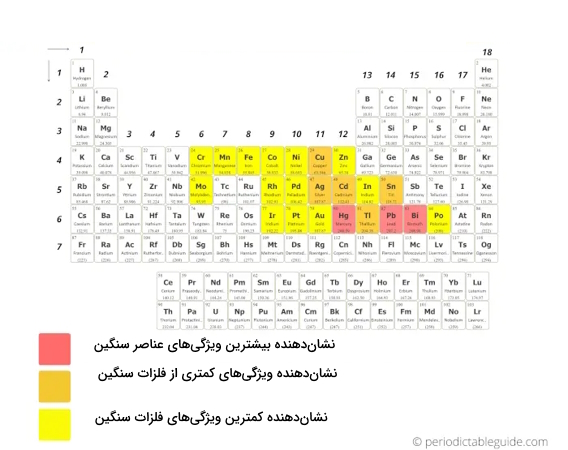








فلزاتی که بیشترین ویژگیهای فلزات سنگین را نشان میدهند عبارتند از:
فلزاتی که ویژگیهای کمتری از فلزات سنگین نشان میدهند عبارتند از:
- مس (Cu)
- نقره (Ag)
- کادمیوم (Cd)
- قلع (Sn)
- تالیم (Tl)
بقیه عناصری که با رنگ زرد نشان داده شدهاند، دربرگیرنده ویژگیهای کمتری از فلزات سنگین هستند.
فلزات با واکنش پذیری بالا
فلزات واکنشی، واکنشپذیرترین فلزات جدول تناوبی، در یک واکنش شیمیایی تمایل زیادی به از دست دادن الکترون یا الکترونهای خود نشان میدهند. میدانیم که در گروههای جدول تناوبی، با حرکت از بالا به پایین، اندازه اتمی افزایش مییابد. بنابراین نیروی جاذبه بین هسته و الکترونهای بیرونیترین لایه کاهش مییابد، به همین دلیل، الکترون به راحتی در طی واکنش شیمیایی از بین میرود، پس در گروهها، با افزایش اندازه اتمی، واکنشپذیری فلزات افزایش مییابد.
موقعیت در جدول تناوبی
فلزات با واکنشپذیری بسیار بالا، در گوشه پایینِ سمت چپ جدول تناوبی قرار دارند. یعنی فلزات قلیایی گروه ۱. در این گروه هرچه از بالا به پایین حرکت میکنیم، واکنشپذیری افزایش مییابد. بنابراین پایینترین عنصر گروه ۱ یعنی فرانسیم واکنشپذیرترین فلز در جدول تناوبی است.
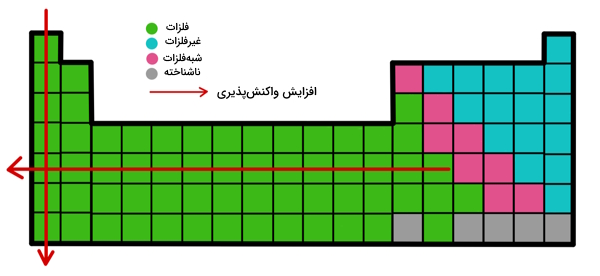








توجه: فرانسیم یک عنصر آزمایشگاهی (a Laboratory Made Element) و در مقدار بسیار کمتری موجود است، از این رو در اهداف عملی، سزیم به عنوان واکنشپذیرترین فلز در جدول تناوبی در نظر گرفته میشود. سزیم نیز واکنشپذیری بسیار بالایی دارد، اما پیشبینی میشود که فرانسیم واکنشپذیری بالاتری نسبت به سزیم داشته باشد.









کاربرد فلزات
فلزات تقریبا در تمامی صنایع و به دنبال آن در تمامی جنبههای زندگی ما کاربرد دارند که در اینجا به برخی از آنها اشاره میکنیم.









از کاربردهای ملموس فلزات در زندگی روزمره نیز میتوانیم به موارد زیر اشاره داشته باشیم.
- آینه
- سکه
- ظروف
- تجهیزات ورزشی
- تجهیزات الکتریکی
- تاسیسات منزل
- تغذیه (آهن، مس، کبالت، نیکل، روی، مولیبدن و…)
- و…
تمرین
برای مرور مباحث، برخی سوالات به همراه پاسخها آورده شده است.
سوال ۱: در عناصر زیر، کدامها فلز هستند؟
Cl، Ca، Na، S
پاسخ: پاسخ را در جدول زیر میبینیم.
| نام عنصر | فلز؟ | دسته فلزات |
| Cl | نیست | – |
| Ca | هست | فلزات قلیایی خاکی |
| Na | هست | فلزات قلیایی |
| S | نیست | – |
سوال ۲: کدامیک از عناصر زیر از عناصر فلزی هستند؟
Kr، Se، Ba، Li
پاسخ: پاسخ را در جدول زیر میبینیم.
| نام عنصر | فلز؟ | دسته فلزات |
| Kr | نیست | – |
| Se | نیست | – |
| Ba | هست | فلزات قلیایی خاکی |
| Li | هست | فلزات قلیایی |
سوال ۳: با استفاده از جدول تناوبی، کدامیک از عناصر زیر، جزو فلزات واسطه و کدامیک جزو فلزات واسطه داخلی محسوب میشوند؟
U، Au، Am، Rh، K
پاسخ: پاسخ را در جدول زیر میبینیم.
| نام عنصر | فلز واسطه | فلز واسطه داخلی |
| U | – | هست |
| Au | هست | – |
| Am | – | هست |
| Rh | هست | – |
دانلود فایلهای جدول تناوبی
فایل پیدیاف و تصویری جدول تناوبیِ فارسی، به همراه تقلبنامه جدول تناوبی از لینکهای زیر قابل دانلود هستند. برای دانلود این فایلها، روی آنها کلیک کنید.
خلاصه مطالب
در طول مقاله حاضر، با تعریف فلزات در حالت کلی آشنا شده و ویژگیهای فیزیکی و شیمیایی آنها را مورد بحث قرار دادیم. سپس به بررسی عناصر فلزی جدول تناوبی از ابعاد مختلف پرداختیم، ازجمله دستهبندیهای آنها به قرار فلزات قلیایی، قلیایی خاکی، واسطه، واسطه داخلی، فلزات خاکی کمیاب، فلزات سنگین و همچنین فلزات واکنشی یا ریاکتیو، و نیز بررسی هر دسته اعم از فلسفه نامگذاری آنها تا ویژگیهای عناصر جایگرفته در هر کدام از دستهها. در انتها نیز نگاهی به کاربردهای فلزات، به عنوان عناصر حیاتی زندگی امروز در صنایع مختلف داشتیم.
